
我院临床试验机构成立于2018年12月,于2019年10月通过12个专业获得国家药监局临床试验资格认定,2020年通过国家局药物临床试验机构备案(备案号:药临床机构备字2020000240),2022年2月新增4个药物临床试验专业组,并通过备案检查。于2018年通过医疗器械临床试验机构备案,备案了11个专业组(备案号:械临机构备201800591),2023年8月新增8个医疗器械临床试验专业组,并通过备案检查。药物临床试验专业组16个,备案PI:34人;医疗器械(含IVD)临床试验19个,备案PI:72人。于2025年成立温州市中心医院临床研究中心(简称中心)。
党委书记沈淑蓉书记担任机构主任,院长担任机构副主任。采取垂直管理,中心下设五个核心部门:国家药物/医疗器械临床试验机构办公室、人类遗传资源办公室、I期临床试验研究病房、研究型病房以及临床研究办公室/临床研究设计部。中心全面负责全院临床研究项目的设计、立项、伦理、合同、启动、试验实施、质控、财务、药品管理、人遗监督和结题等临床研究全流程管理,并积极推动对外交流与合作,协调院内各部门及科室间的科研合作,促进跨学科研究的开展。中心现有14名工作人员,包括研究医生4名、研究护士2名及医技人员8名,覆盖秘书、质量管理、药物管理、档案管理、器械管理、信息化系统管理、人遗管理、生物样本管理及方案设计等岗位。国家药物/医疗器械临床试验机构办公室(简称机构办)作为中心协调管理部门,现有浙江省级骨干GCP检查员1名、温州市GCP检查员1名。
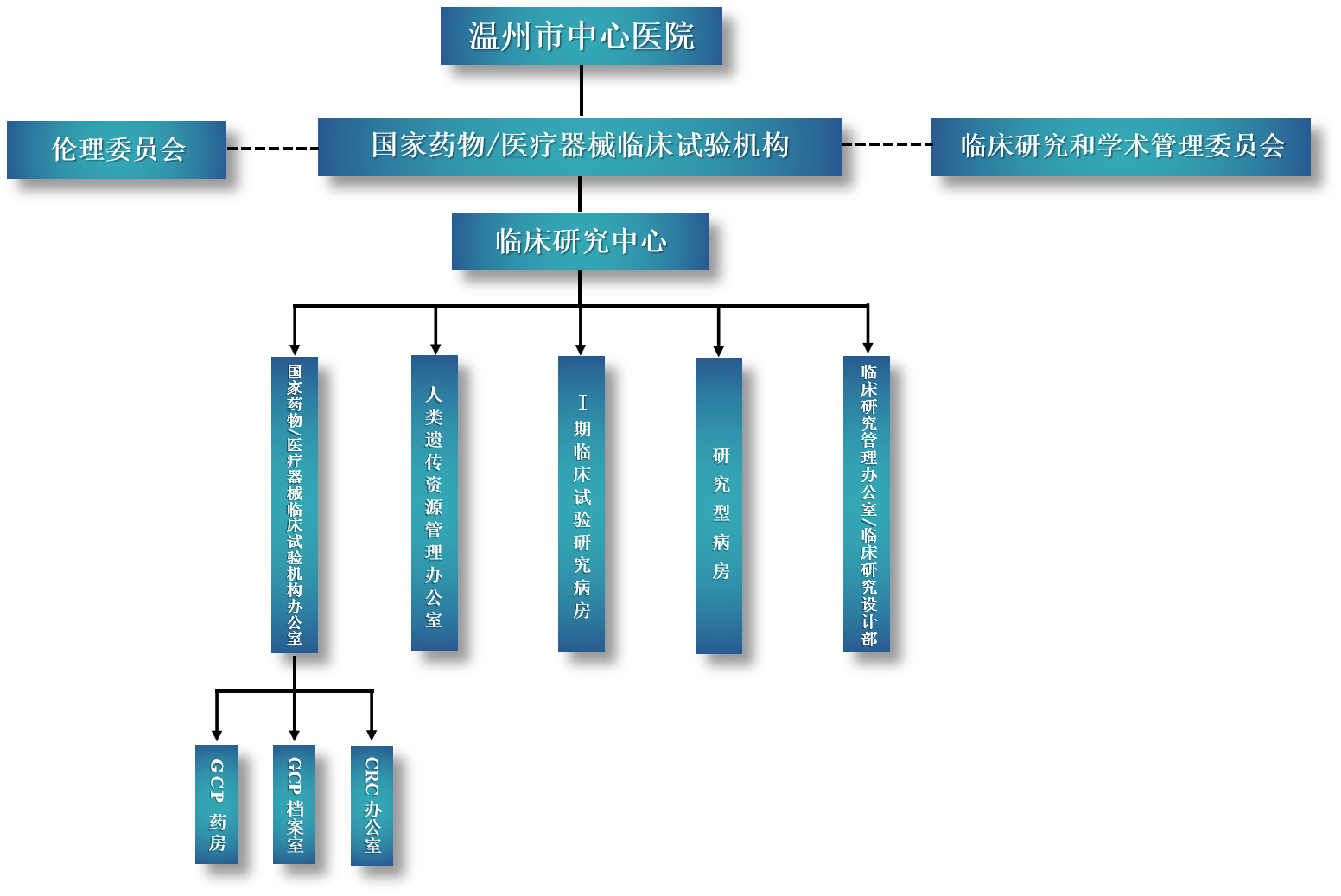
机构组织框架
机构拥有完备的临床试验支撑设施:GCP中心药房、质控室、资料档案室、CRC/CRA办公区、标准化的I临床试验研究室(病房)(1300m3)、人遗办公室、会议室等。建立了完善的制度、SOP体系文件,共计120余个文件,实现标准化操作、严控质量关!建立了院内研究者的激励政策,包括:临床试验纳入了职称晋升考核、年底KPI考核等。
CTMS管理模块和流程由机构办自主设计,联合信息科和第三方公司开发实施,集合了立项审查、伦理审查、合同审查、质控、检验检查开单、物资接收退还、受试者管理及财务结算等功能,经过3年的试运行和优化,初步形成完整的开放式闭环共享生态系统。实现申办者、CRO、SMO、研究者、机构办、伦理及医院财务一体化信息化管理。实现财务入账支出审批全程线上管理,临床试验所涉及的检验检查费用、耗材费用、手术费用等费用实现实时结算,无需垫付,无需手动统计,自动结算导出结算报表。与HIS/LIS/PACS等系统实时对接,实现信息资源共享。试验方案CTMS整体导入,自动生成每个访视期,节点化实施等。
I期临床试验研究室(病房)于2024年7月启动建设,总建筑面积1300余平方,设立44张观察床,具备筛选区、试验区、办公区、观察区及样本处理区等功能区块。设施设备俱全:超低温冷冻冰箱、超净台、低温离心机、UPS、呼吸机、除颤仪、冷藏及阴凉储存药柜等,病区装有同步时钟、门禁系统、监控系统、温度智能监控报警系统。可以开展I期临床试验和生物等效性试验。
近五年,已承担项目300余项,合同总金额7000多万,历年多次合同到账金额市属医院第一,王牌科室合同完成率80%。
机构基本信息

流程创新及快速SSU
1.项目立项
1)本中心为组长单位的多中心项目,优先立项、伦理审查、协议审核及启动前质控。
2)机构立项和伦理初审共用同一套材料,CTMS同步审核,可及时看到审核状态及意见。
3)机构立项无需组长单位伦理批件,立项受理后1个工作日完成首次反馈,立项1-3个工作日。
2.伦理审查
1)一月一次伦理会,可以加急另外加开。
3.协议审签
1)项目立项后,申办者可同步提交临床试验协议进行审核。
2)有多套机构合同模板,提高审核通过率,加速审签时间。
3)协议定稿后,平均5个工作日可完成协议院内审核及签署流程。
4.流程简单易懂
1)一站式服务。一个平台(CTMS),一份指引《临床试验工作指引》。发布于微信公众号“温州市中心医院临床试验机构”、机构办官网、CTMS系统。
2)多途径公开临床试验指南、模板及咨询电话及投诉举报方式。
3)专设温州市中心医院CRA交流群、温州市中心医院CRC工作群,相互学习交流。
4)项目立项到启动平均时间30个工作日。
联系地址:百里东路252号 电话:0577-88070037 传真:0577-88070037
乘车路线:公交康乐坊站:93、84、6、25、29、43、106、92、87,百里坊站: 42、115、105、103、87,
BRT解放街口:B110(原33路)、B111(38路)、B101、B1,BRT环城东路口:B101、B108路(原45路)、B110(原33路)、B111、B112、B113、B1